
14.-144



20.(14分)(1)3(2分)10-5(2分)强电解质(1分)(2)B(2分)(3)多(1分)(4)4.0×10-7(2分)3.2×10-6(2分)(5)13(2分)【解析】(1)25℃时,0.1mol·L1HA溶液中c(OH)=10°,结合K=c(H )·c(OH)=1c(H10-14可得,c(H )=1×10-3mol·L,pH=3HA的电离常数K.=c(H )·c(A1X10-3×1×10-3=10-50.01mol·L1BOH溶液的pH=12,故BOH是强电解质。(2)(H)=K,(HA2,稀释过程中,(A-)减小K,(HA)不变,故H的值增大,A项错误;号“R稀释过程中,c(H )减小,K(HA)不变,故(HAA-)的值减小,B项正确;温度不卖,K=c(H )·c(OH)不变,C项错误;稀释过程中,c(H )减小,c(OHˉ)增大,D项错误(3)HA是弱酸,HA溶液的浓度较大,故HA溶液中产生的氢气较多。(4)纯水中的c(OH-)=c(H )=4.0×10-7mol·L,该沮度下,K=4.0×10-7×4.0×10-7=1.6×10当溶液中c(OH)=5.0×10-mo·L时,由水电离出的c(H)=3.2×10mol·L-。(5)氢氧化钠过量,溶液呈碱性,溶液中c(OH-)=1.2mol·L-1×0.1L-1mol·L-x0.1L0.2L0.1mo!·L-1,溶液的pH=13

以上就是2022英语周报 八年级上册 人教版答案,更多英语周报答案请关注本网站。

 相关文章
相关文章



 栏目最新
栏目最新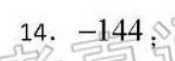

 随机推荐
随机推荐 热门标签
热门标签