

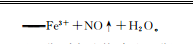
26.(12分,除标注外,每空1分)(1)NOz发生水解反应NOz H2OHNO2 OHˉ,温度升高水解平衡正向移动,碱性增强,溶液红色加深(其他合理答案也给分(2)还原N原子最外层5个电子,十3价不稳定易失电子,体现还原性(其他合理答案也给分)(3)①浅绿色棕色0.5mol·L-Fe2(SO4)溶液(pH=3)②棕色溶液中的[Fe(NO)]受热生成NO和Fe2 ,NO被空气氧化为NO2,加热有利于Fe2 被氧化为Fe3 ,促进Fe 水解,产生Fe(OH)3沉淀(2分,其他合理答案也给分)(4)①阻碍Fe2 与NO接触,避免络合反应发生(2分,其他合理答案也给分)②Fe2 NO 2H一Fe NO↑ H2O(2分)【解析】(1)NaNO2为强碱弱酸盐,NOˉ发生水解反应NOz H2O←HNO2 OH-,温度升高水解平衡正向移动,碱性增强,溶液红色加深。(2)KMnO4溶液紫色褪去,即KMnO4被还原,说NO2具有还原性。NO2具有还原性的原因是:N原子最外层5个电子, 3价不稳定,易失电子,体现还原性(3)①若要证明棕色物质是NO与Fe2 ,而非Fe发生络合反应的产物,需要作对照实验,即pH均为3,含Fe2 和Fe3 物质的量浓度均为1mol·L-1的FeSO4溶液和Fe2(SO4)3溶液中通人NO,若通入FeSO4溶液出现溶液由浅绿色迅速变为棕色,而通人Fe2(SO4)3溶液无现象,则可证明。②气体在接近试管口处变为红棕色,说明有NO生成,溶液中有红褐色沉淀,说明有Fe(OH)3生成,原因是棕色溶液中的[Fe(NO]受热生成NO和Fe2 ,NO被空气氧化为NO2,加热有利于Fe2 被氧化为Fe3,促进Fe3 水解,产生Fe(OH)3沉淀,(4)①由图可知,该装置构成了原电池,两电极分别产生NO和Fe3 ,中间盐桥的作用是阻碍Fe2 与NO接触,避免络合反应发生②该原电池总反应方程式为Fe2 NOz 2H Fe3 NO↑ H2O


35.(15分)(1)5(1分)球形、哑铃形(或纺锤形)(2分)4(2分)(2)①N(1分)②sp2(1分)(3)①F的电负性大于H,故NF3中N周围的电子密度小于NH1中N周围的电子密度,成键电子对间排斥作用小(2分,其他合理答案也给分)②四面体形(1分)(4)7:1(2分)(5)①正八面体(1分)②2×√NA0×10(2分)【解析】(1)1个原子轨道称为1个空间运动状态,基态N原子核外电子占据5个原子轨道,故有5个空间运动状态;占据最高能层电子包含2s、2p,电子云轮廓图形状为球形、哑铃形(或纺锤形)。基态Cu原子的未成对电子数为1,第四周期基态原子中,未成对电子数为1的还有K、Sc、Ga、Br四种(2)①H、C、N、O、S中,第一电离能最大的是N。②[C(NH2)3] 中碳原子的价层电子对数为3,杂化方式为sp2(3)①F的电负性大于H,故NF3中N周围的电子密度小于NH3中N周围的电子密度,成键电子对间排斥作用小,使NF1的键角小于NH2②NF中N原子的价层电子对数为4, VSEPR模型为四面体形。(4)1个[Cu(NH2)3CO] 中含有14个a键、2个r键,数目之比为7:1。(5)①晶胞中Cu原子与N原子数目之比为3:1,根据晶胞结构知,小黑球为N原子、大黑球为Cu原子,故与N原子紧邻的所有Cu原子堆积成的几何构型为正八面体。②由晶胞结构知,每个品胞中含有3个Cu原子和1个N原子,两个Cu原子间的最短距离为面对角线的,设晶胞参数为a,品体密度pg·cm=308,解得a=206206NNcmN NAP107m,两个Cu原子间的最短距离为NAPX10 nm

以上就是2022英语周报感啦啵仿真试题答案,更多英语周报答案请关注本网站。

 相关文章
相关文章



 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签