


1.(1)B(1分)(2)Be0 2NaOHNa, BeO, H,O(l sr(3)前三种为离子晶体,品格能依次增大,后三种为分子晶体,分子间作用力依次增大(1分)(4)氧原子的半径小于硫原子半径,所以H-O键的键长小于H-S键的键长键长越短键能越大,稳定性越强(1分)>(1分)氧原子的半径小于硫原子的半径,水分子中两个氢原子的距离较近,它们之间的斥力较强,键角较大,而硫化氢中氢原子的距离远些,所以斥力较小,硫化氢的键角就比水小(2分)(5)平面三角形(1分)(6)C(1分)NA(0.46653107)(2分)(7)8×7 4×16【解析】(1)A表示的是基态硼原子的最外层电子排布图,B表示的是激发态的硼原子排布图,C表示的是硼原子失去2个电子的电子排布图,所以最容易失去电子的是B(2)由图可知,Be和Al位于对角线的位置,二者的化学性质相似,所以氧化铍与氢氧化钠溶液反应的化学方程式为BeO 2 Naoh-Na2BeO2 H2O(3)NaF、MgF2和AF3为离子晶体,晶格能依次增大,熔点依次升高,而SiF4、PF5和SF6为分子晶体,分子间作用力依次增大,熔点依次升高。(4)氧原子的半径小于硫原子半径,所以H—O键的键长小于H-S键的键长键长越短键能越大,稳定性越强;由于氧原子的半径小于硫原子的半径,水分子中两个氢原子的距离较近,所以它们之间的斥力较强键角较大,而硫化氢中氢原子的距离远些,所以斥力较小.硫化氢的键角就比水小。(5)由价层电子对互斥理论可知,CO3-的空间构型为平面三角形。(6)根据结构图可知,活泼金属和酸根离子之间存在离子键,非金属元素之间存在共价键,分子之间存在范德华力,水分子之间存在氢键,不存在的作用力是金属键。故选C。(⑦)根据晶胞的结构,Li在结构内部,个数为8.O在顶点和面心,个数为8Xg 6×2=4,故晶胞的密度7×8 16×4)g8×7 4×16NA×(0.4665nm)3NA(0.4665×10-7)gcm-3


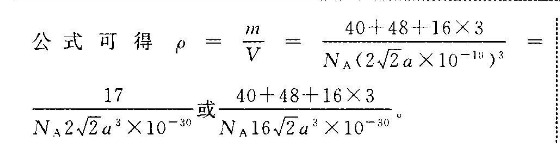
4(1)国k1分)第四周期第Ⅷ族(1分)<(1分)Fe失去第三个电子后价电子变为3d,是半充满结构较稳定,N失去三个电子后价电子变为3d,较容易失去第四个电子,所以失去第四个电子所需能量Ni小于Fe(2分)(2)(SiO1)10-(2分)(3)①0.315(1分)12(1分)② Catic3(2分)N422a3X10m(或40 48 16×3(2分)17NA16√2a3×10-0)【解析】(1)基态Cr的核外有24个电子,所以价电子排布图为团N是28号元素,位于元素周期表的第四周期第Ⅷ族,Fe失去第三个电子后价电子变为3d,是半充满结构较稳定,Ni失去三个电子后价电子变为3d,较容易失去第四个电子,所以失去第四个电子所需的能量N小于Fe。(2)将左边结构补全会形成两个环,被两个环共用的氧原子左边有7个,右边有7个共14个,独立成个体的氧原子共有10个(上边有5个,下边有5个),同时每个环都有独立的硅原子,则N(Si):N(O)=(4 4×0.5):(14×0.5 10)=6:17,这样,每个环所包含的氧有17个,硅有6个,再根据Si 、O2-的化合价,其结构式的通式为(Si4O17)n0(3)①K与O间的最短距离为面对角线的一半,则K与O间的最短距离为×0.446nm≈0.315mm,与K紧邻的O在以K为顶点的正方形的面心,一个晶胞中距离顶点K最近的O有3个,顶点处的K被8个晶胞共有,面心O被2个晶胞共有,所以与K紧邻的O的个数为3×8×2=12。②根据钙钛矿CaT,O4的晶体结构分析Ca2 位于晶胞的体心,Ti位于晶胞的顶点,O2位于以Ti 为体心的正八面体的顶点,则一个晶胞中含有1个Ca2 、1个Ti 和3个O2-,则化学式为CaTO3,Ca2 和O2-之间的最短距离为apm,则晶胞参数为2apm.一个品胞相当于有一个CaTO3,根据密度公式可得40 48 16×NA(2√2a×10或40 48 16×3N、2√2a2×10-3NA162a2×10-80

以上就是高一英语周报43期2022答案,更多英语周报答案请关注本网站。

 相关文章
相关文章


 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签