
2.D【解析】②C(s) O2(g)一CO2(g)△H1=-393.5kJ/mol,③N2(g)十O2(g)=2NO(g)△H2= 180.5kJ/mol,根据盖斯定律,将②-③得:C(s) 2NO(g)=N2(g) CO2(g)△H=(-393.5kJ/mol)-( 180.5kJ/mol)=-574.0kJ/mol,故A正确;C(s) 2NO(g)一N2(g)十CO2(g)是气体质量逐渐增大的反应,当容器内气体密度不变时,说明气体的质量不变,说明反应达到了平衡状态,故B正确;反应的焓变=正反应的活化能一逆反应的活化能,反应③N2(g) O2(g)-2NO(g)△H2= 180.5kJ/mol,则正反应的活化能大于180.5kJ/mol,故C正确;反应①C(s)十2NO(g)一N2(g)十CO2(g)为气体的物质的量不变的反应,容器中的气体的压强始终不变,达到平衡后,增大压强平衡不移动,故D错误。

7.C【解析】化学平衡状态的实质是正反应速率等于逆反应速率,C点对应的正反应速率还在改变,未达平衡,A错误;a到b时正反应速率增加,反应物浓度随时间不断减小,B错误;达平衡前,随着反应的进行,S)2的转化率一直在增大,C正确;从a到c正反应速率增大,之后正反应速率减小,说明反应刚开始时温度升高对正反应速率的影响大于浓度减小对正反应速率的影响,说明该反应为放热反应,即反应物的总能量高于生成物的总能量,D错误。

以上就是2022-2022高三英语周报答案,更多英语周报答案请关注本网站。

 相关文章
相关文章
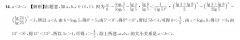

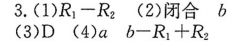
 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签