


20.(14分)(1)1分)球形(1分)(2)小于(1分)Zn原子半径小,且价电子排布为全满结构,第一电离能更大(1分)(3)平面三角形(1分)(4)F>N>H(1分)sp3(1分)HF分子间能形成氢键(1分)(5)①1:1(2分)②2.06×19(2分,其他合理答案也给分)③(0,,)(2分)【解析】(1)基态F原子的价电子排布式为2s2p3,2其轨道表达式为回基态Zn原子的价电子排布式为3d04s2,占据最高能层电子的电子云轮廓图形状为球形。(2)K与Zn属于同一周期,Zn原子半径小,且价电子排布式为3d04s2的全满结构,故K的第一电离能小于Zn的第一电离能(3)CO中C原子的价层电子对数为3,孤电子对数为0,其立体构型为平面三角形(4)元素的非金属性越强,电负性越大,故NHHF2的组成元素的电负性由大到小的顺序为F>N>H;其中N原子的价层电子对数为4,杂化方式为sp2;HF分子间能形成氢键故能形成分子缔合体(HF)(5)①由图可知,ZnF2中Zn的配位数为6, KZnF3中Zn的配位数为6,二者之比为1:1②每个ZnF2晶胞中含有2个Zn2和4个F-,ZnF2晶体的密度为103×2gNA·(a×10-cm)2×(c×10-cm)2.06×102Na2g·cm-s③由晶胞结构图知,D点原子处于面心位置,D的原子坐标参数为(0,2·2)

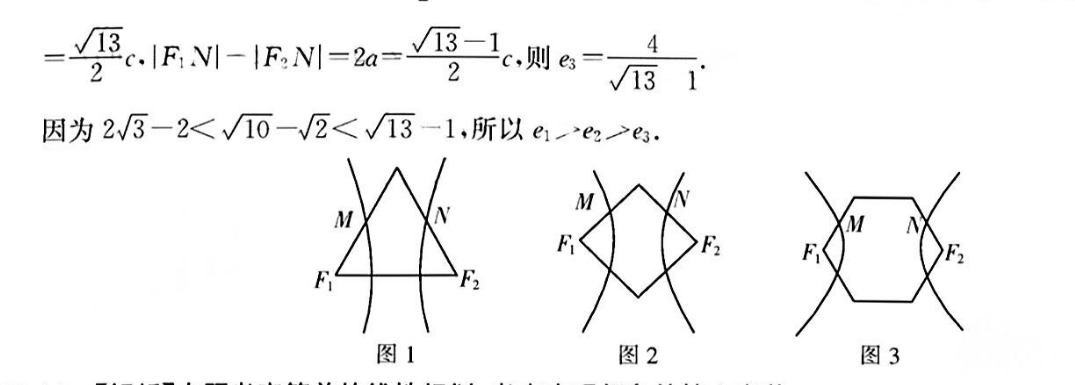
12.A【解析】本题考查双曲线的离心率,考查直观想象、逻辑推理的核心素养在图1中.1FB|=2.FN川-|F,N=2a=(5-1c,则a=223-2在图2中,1FF1=2c,FN1-√号e) 2o2=c,R,N1-号c.RN1-IRN1=2a=而,则后2在图3中.F,F2|-2c.F,N-2c,由余弦定理可得,FN川=√FF2 FN-2FFF2Ncos60平RM-FN-2a=及1则s421因为23-2<√0-√2<√13-1,所以e1>e3>e.MM图1图2图3

以上就是学英语周报2021-2022高三江苏第14期答案,更多英语周报答案请关注本网站。

 相关文章
相关文章



 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签