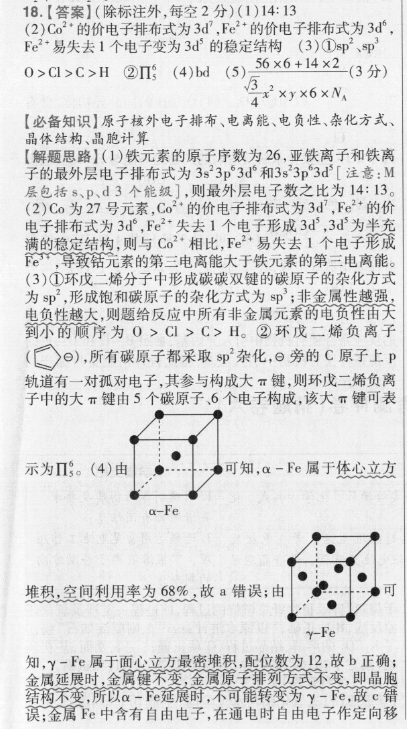

18.【答案】(除标注外,每空2分)(1)14:13(2)Co2·的价电子排布式为3d',Fe2 的价电子排布式为3d°,Fe2 易失去1个电子变为3d的稳定结构(3)①sp、p0>C>C>H②Π(4)bd(5)56×6 14×2(3分)324×yx6×N【必备知识】原子核外电子排布、电离能、电负性、杂化方式、晶体结构、晶胞计算【解题思路】(1)铁元素的原子序数为26,亚铁离子和铁离子的最外层电子排布式为3s23p3d和3s23p3d[注意:M层包括s、P、d3个能级],则最外层电子数之比为14:13。(2)Co为27号元素,Co2·的价电子排布式为3d',Fe2 的价电子排布式为3d°,Fe2 失去1个电子形成3d°,3d为半充满的稳定结构,则与C02·相比,Fe2 易失去1个电子形成e,导致锫元素的第三电离能大于铁元素的第三电离能。(3)①环戊二烯分子中形成碳碳双键的碳原子的杂化方式为sp,形成饱和碳原子的杂化方式为sp;非金属性越强,电负性越大,则题给反应中所有非金属元素的电负性由天到小的顺序为0>C1>C>H。②环戊二烯负离子(○⊙),所有碳原子都采取sp杂化,⊙旁的C原子上P轨道有一对孤对电子,其参与构成大π键,则环戊二烯负离子中的大π键由5个碳原子,6个电子构成,该大π键可表示为Π%。(4)由可知,a-Fe属于体心立方a-Fe堆积,空间利用率为68%,故a错误;由-Fe知,y-Fe属于面心立方最密堆积,配位数为12,故b正确;金属延展时,金属健不变,金属原子排列方式不变,即晶胞结构不变,所以a一下e延展时,不可能转变为y-Fe,敌c错误;金属F中含有自由电子,在通电时自由电子作定向移动形成电流而导电,故d正确。(5)由晶胞结构可知,晶胞含有12×。 2×? 3=6个Fe原子,含有2个N原子,六棱柱的底面由6个正三角形构成,正三角形的高为号m,每个正三角形的面积为?m,晶胞的体积为6×m,则品胞的密度为6×6 14×2g·cm3。


17.【答案】(1)AC(2分)(2) 328.4kJ·mol-(2分)(3)BC(2分)(4)甲为绝热容器,PCL,与CL2发生放热反应,随着反应进行温度逐渐升高,温度越高反应速率越大(2分)(5)0.42(2分)(6)H(2分)C0(NH2)2 80H-6e=C0号 N2↑ 6H20(2分)【关键能力】分析与推测能力、归纳与论证能力【解题思路】(1)反应①是吸热反应且是气体分子数增大的反应,为提高甲烷的平衡转化率,应采取高温低压,增大H,S与CH,初始物质的量之比的条件,A、C正确,B错误,加入催化剂不能改变甲烷的平衡转化率,D错误。(2)根据盖斯定律,题给反应=③×2 ②可得△H=(34.0×2 260.4)kJ·mol-1= 328.4k·m0-。(3)混合气体质量不变,体积是恒定的,所以气体密度一直不变,A错误:氯气与五氯化磷位于可逆反应的两边,且化学计量数之比为1:1,因此v正(Cl2):逆(PCL)=1:1时可以判定反应达到平衡状态,B正确;题给反应是气体分子数变化的反应,当压强不再改变时反应达到平衡获态,C正确;粮据混合气体中c(PC1,)=c(P℃,)无法判定是否达到平衡状态,D错误。(4)甲为绝热容器,反应PCl3(g) Cl2(g)一PCl(g)为放热反应,放出的热量对反应速率的影响较大,故1~6s内PC1的浓度迅速减小。(5)n(AgNO)=34g170g·mol70.2mol,结合题给信息混合气体含有N02,AgNO→NO中N元素化合价降低,因此分解时还应生成O2,设二氧化氨消耗的物质的量为2xmol,列三段式如下:2N02(g)一N204(g)起始的物质的量/mol0.20转化的物质的量/mol2xX平衡时的物质的量/mol0.2-2xn(02)=0.1mol,平衡时混合气体总物质的量等于0.2mol2xmol xmol 0.1mol=0.25mol,解得x=0.05。平衡时,p(NO2)=3.0MPa×0.10.25=1.2MPa,p(N204)=0.6MPa。K-N0)0.6(MPa)-1≈0.42(MPa)-。(6)此装p2(N02)1.22置是制氢装置,电解液为碱性,则阴极的电极反应式为:2H20 2eˉ一H2↑ 20Hˉ,故气体B为氢气;再根据题意分析尿素中各元素化合价的变化可知,气体A为氮气,阳极的电极反应式为C0(NH2)2 80H-6eˉ一CO N2↑ 6H20。

以上就是英语周报2021-2022高二第28期答案,更多英语周报答案请关注本网站。

 相关文章
相关文章



 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签