


17.(12分解:(1)∵ acOSO ccos d -2 bcos B=0sincos c sin c cos 2sin Bcos=02分in(A C)=-2sim BcosB, E sinB=-2sin BcosB0




16.(14分)(1)ACD(2分,漏选得1分,错选得0分)(2)Cu2S 2MnO2 8H 一2Cu2 2Mn2 4H2O S(2分)(3)3.3≤pH<4.2(2分)(4)CuSO, 5NH3. H, 0 NH HCO3=(NH,), SO [Cu(NH,)4JCO3 5H20(2 4)(5)蒸发浓缩、冷却结晶(2分,其他合理答案也给分)(6)①检验晶体中的结品水是否已全部失去(或确保晶体中的结晶水已全部失去)(2分)②CuSO4·3H2O(或CuSO4·H2O)(2分,写一个或都写均得分)【解析】(1)预处理时用破碎机将铜矿石破碎成粒子直径<1mm的铜矿粉,可以增大反应物的接触面积,使反应更加充分,加快反应速率,提高浸取率,A正确;“络合反应”中采用高温,氨水受热会挥发,碳酸氢铵会分解,反应会受到不利影响,B项错误;“蒸氨”时产生的氨气直接排出,会污染空气,若用定浓度的硫酸溶液吸收净化,可以防止污染空气,所得的硫酸铵溶液可作化肥,C项正确;“一系列操作”中,采用常压过滤或减压过滤都可以得到硫酸铜晶体,D项正确。(2)反应I中Cu2S被MnO2氧化,得到Cu2 和S单质,根据电子守恒可知,Cu2S和MnO2的系数比为1:2,再结合元素守恒可得离子方程式为Cu2S 2MnO, 8H --2Cu2 2Mn2 4H2 0 S(3)加氨水中和溶液调pH的目的是除去Fe,根据题中所给数据,pH为3.3时Fe2 沉淀完全,小于4.2时Cu2 未沉淀,所以pH范围为3.3≤pH<2(4)由已知I,“络合反应”中可形成配合物Cu(NH3)4]CO3,结合流程确定反应物为CuSO4、NH3·H2O和NH4HCO2,所以反应的化学方程式为CuSO4 5NH3·H2O NH4HCO3一(NH,),SO, [Cu(NH3),JCO, 5H2O.(5)由分析可知,经蒸发浓缩、冷却结晶析出硫酸铜晶体。(6)①晶体中所含结晶水通过重量分析法测定时,重复置于烘箱中脱结晶水、冷却、称量的操作可以确保晶体中的结晶水已全部失去,减少测定结晶水含量的误差。②CuSO4·5H2O的摩尔质量为250g·mol-,由图可知,温度加热至100℃左右质量分数减小14.4%,即250×14.4%=36,为2个水分子的相对质量,因此此阶段发生的反应是CusO4·5H2O=CusO·3H2OH2O;10℃升高到125℃左右,质量分数减小14.4%,即250×14.4%=36,为2个水分子的相对质量,因此此阶段发生的反应是CuSO1·3H2O=CuSO·H2O 2H2O;250℃以后质量分数减小7.2%,即250×7.2%=18,为1个水分子的相对质量,因此此阶段发生的反应是CuSO4·H2O==CuSO4 H2O所以若测得结晶水的含量偏低,则可能是因为受热后的晶体中存在CuSO1·3H2O或CuSO4·H2O

以上就是英语周报2022-2022第四答案,更多英语周报答案请关注本网站。

 相关文章
相关文章

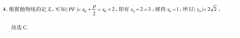
 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签