
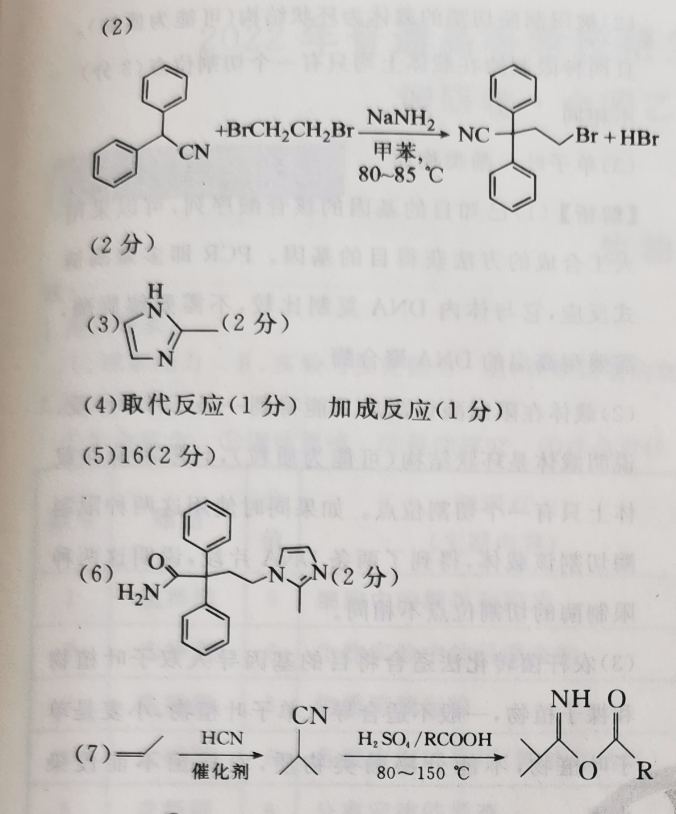
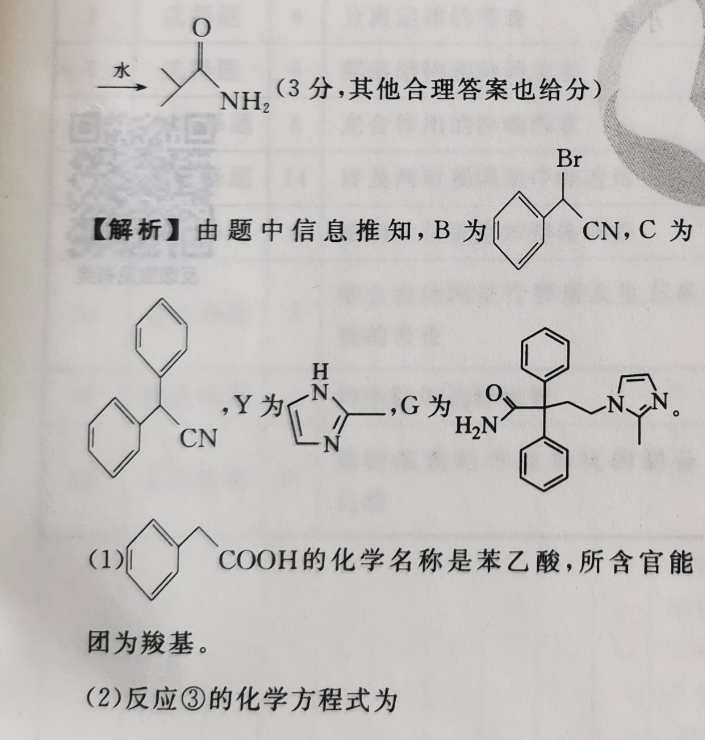
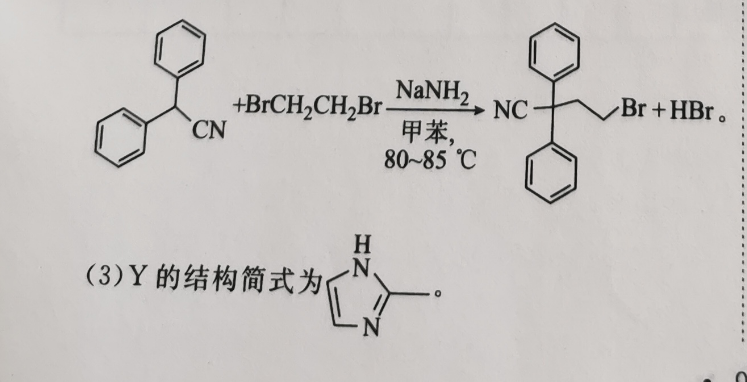


36.(15分)(1)苯乙酸(1分)羧基(1分)(2) BrCH2 CH2 BINCBr HBr甲苯8085℃(2分)(3))(2分)(4)取代反应(1分)加成反应(1分)(5)16(2分)(6)分)H2NH OCNHCNH, SO,/RCOOH(7)催化剂O RO水NH,(3分,其他合理答案也给分)Br【解析】由题中信息推知,B为CN,C为H人,Y为、,6为,0CNHONCOOH的化学名称是苯乙酸,所含官能团为羧基。(2)反应③的化学方程式为BrCH2CH2 NaNHz, nc 、B HBrCN甲苯,80~85℃H(3)Y的结构简式为NBI(4)反应①由CN转化为CN,发生取代反应;反应⑤由NCNN与 RCOOH反应生成HNN、小N,属于加成反应。RCOO(5)有机物B的同分异构体中,除含苯环和一NH2外,还含有一Br和一C=C—,若苯环上连有三个取代基:Br、NH2和—C=CH,有10种结构;若苯环上连有两个取代基:Br和C=C—NH2或一NH2和C=CBr,各有3种结构;故共有16种符合条件的同分异构体。(6)G的结构简式为HNCN(7)丙烯先与HCN加成得到人,类比反应⑤,CN与 RCOOH发生加成反应,然后水解即可得到ONH2°


26.(15分)(1)SiO2、PbSO4(2分)(2)补充反应物H,并防止Sn1和Fe3 水解(2分)(3)2Fe2 C10 2H -2Fe't Cl H2O(2分)(4)①当pH大于a时,随着pH的增大,Sn4水解产生的Sn(OH)4增多,导致萃取率降低(2分)②0.55(2分)(5)Fe、Zn2 (1分)2.0×10-5(2分)(6)SnO 2HCO3-SnO2 2C03 H2O(2分)【解析】(1)“酸溶”所得溶液中含有SnSO4Sn(SO4)2、FeSO4、Fe2(SO4)3、ZnSO;“酸溶渣”的主要成分为SiO2和PbSO4。(2)“氧化”步骤消耗H ,向溶液中补充硫酸可提供反应物H ,并防止Sn和Fe3 水解。(3)“氧化”步骤Fe2发生反应的离子方程式为2Fe CIO 2H -2Fe CI H2 O.(4)①当pH大于a时,随着pH值增大萃取率减小的原因为随着pH的增大,Sn1水解产生的sn(OH)4增多,导致c(Sn1)降低,萃取平衡逆向移动,导致萃取率降低。E%②当pH=0.23时,萃取率为50%,此时1g1=E%gK 4lgc(HA) 4pH=0,当pH=a时,萃取率为95%,g1-E%=gK 41gc(HA) 4pH=g19=1.28,K和c(HA)一定,则a=0.55(5)“萃取”后“水相溶液”的pH约为0.8,在“分步沉淀”时用NaOH逐步调节pH至9.5,依次沉淀完全的金属离子是Fe3 、Zn2 ;K甲[Zn(OH)2]=2.010-15,pH=9.5时,c(OH)=105mol·L-,K[Zn(OH)2]=c(Zn2)×c2(OH)=2.010-15,故c(Zn2 )=2.0×106mol·L1。(6)“沉锡”过程发生反应的离子方程式为SnO3 2HCO3-SnO2 2CO3 H2O

以上就是2022年学生周报六年级答案,更多英语周报答案请关注本网站。

 相关文章
相关文章


 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签