

10-14,NH4A(SO4)2溶液中的H 全部来自水的电离,故水电离出的c(H )=1×103mol·L,②根据物料守恒可知,c(NH) c(NH2·H2O)=e(AP ) C[A《OH],根据电荷守恒可知,2c(90)十c(OH)=c(NH) 3c(A ) c(H),则2c(sG-)c(NH*)-3c(Al )=c(H )-c(OH)=(1×1031×10-1)mol·I(2)NH4A(SO1)2溶液中存在NH 、AP 的水解平衡,盐类水解吸热,升高温度,水解平衡正向移动,溶液中c(H )增大,故溶液的pH减小(3)①a点溶液中的溶质为(NH4)2SO4和Na2SO,NH水解促进水的电离;b、c两点溶液所含溶质均为(NH4)2SO4、Na2SO4和NH·H1O,且c点cNH4·H2O大于b点,NH3·H2O抑制水的电离,则c点水的电离程度小于b点;d点溶液中的溶质为Na2SO4和NH·H2O,水的电离程度:a>b>c>d故水的电离程度最小的是d点②向NH4HSO溶液中滴加NaOH溶液至a点过程应的离子方程式为H OH—H2OHHSO溶液中,各离子浓度由大到小的顺序A c(H")>E(SO- )>c(NH*)>c(OH19.(16分)(1)①1×10-1(2分)1×10-3(2分)②=(2分)1×101-1×10-1(2分)(2)升高温度,NH、A3 的水解平衡均正向移动,溶液中c(H )增大(2分)(3)①d《2分)②H OH一H2O(2分)③(H )>c(SC-)>c(NH 》>c(OH)(2分)【解析】(1)①常温下,水的离子积常数K.=1

14.BD【解析】E点为新制氯水溶液,具有漂白性,不能用pH试纸测溶液的pH,A项错误;H点溶液呈碱性,c(OH)>c(H ),根据电荷守恒:c(Na) (H )=c(OH) c(C1-) c(ClO-)可知,c(Nat)>c(Cl-) c(ClO,),B项正确;加水稀释H点对应的溶液,溶液pH减小,C项错误;G点溶液中的溶质为等物质的量的 Naclo、NaCl,ClO水解使溶液呈碱性,故c(Na )>c(Cl-)>c(ClO-)>c(OH)>c(H),D项正确。

以上就是英语周报20192022高二课标33答案,更多英语周报答案请关注本网站。

 相关文章
相关文章


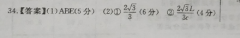
 栏目最新
栏目最新

 随机推荐
随机推荐 热门标签
热门标签