
13.e2【解析】由题得,f(x)=a-,x∈(0,e],当d≤时,(x)≤0,f(x)在(0,e]上是减函数,所以f(x)-mn=f(e)=ae-1=3,解得a=(舍去);当a>1时,若0



21.(13分)(1)A(1分)(2)2MnO2 Cu2S 8H =S 2Cu2 2Mn2 4H2O(3分3)Fe3 可催化MnO2氧化Cu2S(2分)(4CuOL或Cu(OH)2](2分,其他合理答案也给分)加热(1分)(5)Mn2 HCOa NH3 -ma, NHA(2 45)(6)(NH4)2SO4(2分)【解析】(1)延长浸取时间并不能提高浸取速率,故选A项。(2)“浸取”时,酸性条件下,MnO2与Cu2S反应生成s、CuSO4、MnSO4和H2O,离子方程式为2MnO2 Cu2S 8 =S 2Cu2 2Mn2 4H2O(3)若先除铁再浸取,浸取速率明显变慢,可能的原因为F93 可催化MnO2氧化Cu2S(4)最后要制备碱式碳酸铜则加入的试剂A可以是CuO或Cu(OH)2等;氨气易挥发,加热可促进挥发。(5)“沉锰”(除Mn2 )过程中,加入碳酸氢铵和氨气,生成MnCO3沉淀,反应的离子方程式为Mn2 HCO3 NH3—MnCO3↓ NH 。(6)滤液Ⅱ经蒸发结晶得到的盐主要是(NH4)2SO4

以上就是英语周报 2018-2022 高一 新目标 1答案,更多英语周报答案请关注本网站。

 相关文章
相关文章


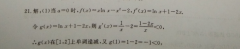
 栏目最新
栏目最新


 随机推荐
随机推荐 热门标签
热门标签