

0.(10分)(1)500℃、m(NH4Cl)m(菱锰矿粉)=1.10(1分)(2)MCO 2 NH C-MnCI2 2NH↑ COh↑H2O2分)(3)MnO, 2Fe 4Ht-wMn 2Fe 2H2 O(2分(4)Mn2 2HCO" -MnCO, CO:4 H2O2分)5)cO-的水解程度敦大,碳酸铵溶液中c(OH较大,易产生Mn(OH)2沉淀(1分【解析】(1)由图可知,氯化铵焙烧菱锰矿粉的最佳条件是500℃、mCNH4C):m(菱锰矿粉)=1.10,(2)“焙烧”时发生的主要反应的化学方程式为MrCO2 2NH4 Cl-MnCl2 2NH3↑ CO2↑十H2O3)MnO2将Fe氧化为Fe ,反应的离子方程式为MnO 2Fe 4H ?T 2Fe 2H2O(4》“碳化结晶”时,反应的离子方程式为Mn24 2 HCO -MnCO2 CO2↑ H2OO的水解程度较大,碳酸铵溶液中c(OH-)易产生Mn(OH)2沉淀故“碳化结晶”过程中不能用碳酸铵溶液代蒈碳酸氢铵溶液体积为a0.00mL,根据关系式:MnCOLMn(PQ):~(NH)zFe(SO)2可知,n(MC)=n硫酸亚铁铵)=0.2000mol·L-tx0.02L0.004mol,产品的纯度为叫mE则x


19,(10分)(1)SiO2 2OH---SiO: H, O(1 s) Fe2 3NH,.H2O-Fc(OH), 3NH*(1 5)(2)CuS、FoS(1分)BeO}- 4H 一Be2 2H2O(2分)(3)在HC气流中加热蒸干BeCl2溶液(2分)(4)MnO, CuS 4H -Mn' Cu S 2H2O(2分)5)Fe (1分)【解析】(1)彼铜元件中SO2和NaOH溶液反应的离子方程式为SiO2 2OH—SO- H2O,生成红褐色固体的离子方程式为Fe 3NH1·H2O一Fe(OH) 3NH,2)CuS、FeS不与NaOH溶液反应,故滤渣B的主要成分为Cus、FeS,Na2BeO2与过量盐酸反应的离子方程式为BeO- 4HBe; 2H2O(3)BeCl2易发生水解,从“BeCl溶液→BeCl2固的操作为在HC气流中加热蒸干BeCl2溶液4)酸性条件下,MnO2和CuS反应的离子方程式为MnO CuS 4H -S Mn Cu 2H: O.(5)由题中数据可知,当c(OH)=10-1mdl·L时,开始形成Cu(OH)2沉淀,当e(OH)拓X10-1mol·L时,开始形成Fe(OH)沉c(OH)=√21×10-6mol·L时,开始形成MnOH)2沉淀,故首先沉淀的是Fe ,

以上就是2022高中英语周报,高考英语模拟冲刺卷答案,更多英语周报答案请关注本网站。

 相关文章
相关文章


 栏目最新
栏目最新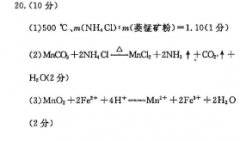

 随机推荐
随机推荐 热门标签
热门标签