
11.Bc



28.(14分)I(1)CO2 3H2 FCH3 OH H2O(2)(2)6.0(2分)Ⅱ.(3) 98.9kJ/mol(2分)(4)①CO2可消耗H2生成CO,减少H2的浓度促进反应ⅰ正向进行,同时产生的CO可进一步消耗CH3OH,从而提高CH3OH的转化率(2分)② HCOOCH3(2分)H2(2分)③(2分)【解析】I.(1)由图可知,CO2与H2重整制备甲醇的总反应方程式为CO2 3H2=CH3OH H2O(2)单位时间内CO2的流量为10mL·min-1,CO2的转化率为60%,则CO2的反应速率为10mL·min1×60%=6.0mL·min1。(2)单位时间内CO2的流量为10mL·min-1,CO2的转化率为60%,则CO2的反应速率为10mL·min-1×60%=6.0mL·min-1。Ⅱ.(3)根据盖斯定律可知,△H1=△H3-△H=29.1kJ/mol-(-128.0kJ/mol) 98.9 kJ/mol(4)①CO2可消耗H2生成CO,减少H2的浓度促进反应正向进行,同时产生的CO可进一步消耗CH3OH,从而提高CH3OH的转化率。②350℃时CH3OH的转化率为72%,则有1.44 mol cI3OH参加反应,产物中的氢原子全部来源于CH3OH,根据原子守恒和图中数据可知,a代表 HCOOCH3,b代表H2。③由图可知,350℃时,平衡时各产物的物质的量分别为n(CO)=0.40mol,n(H2O)=0.60mol,n(H2)=0.64mol,n( HCOOCH3)=0.82mol,则参加反应的CO2的物质的量为0.60mol,平衡时n(CO2)=0.40mol,故反应‖的平衡常数K=20.4mol0.6m0150.4mol0.64mol16°VL

以上就是周报新目标八年级2022答案,更多英语周报答案请关注本网站。

 相关文章
相关文章
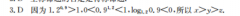


 栏目最新
栏目最新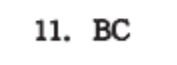

 随机推荐
随机推荐 热门标签
热门标签